
اکسیداسیون شامل فرایندهایي هستند که اساس آنها بر تولید رادیکالهاي آزاد هیدروکسیل است که توانایی زیادي در تجزیه مواد آلی مختلف دارند. روشهاي اکسیداسیون به دو روش:
الف) اکسیداسیون شیمیایی با استفاده از مواد اکسیدکننده نظیر اشعه فرابنفش، آب اکسیژنه، معرف فنتون، اشعه گاما
ب) فرایندهاي اکسیداسیون پیشرفته شامل کاربرد اُزن، اُزن- اشعه فرابنفش، اُزن-آب اکسیژنه، اُزن-آب اکسیژنه-اشعه فرابنفش، آب اکسیژنه-اشعه فرابنفش، دي اکسید تیتانیوم- اشعه فرابنفش می باشد.
فرايندهاي اكسيداسيون شيميايي به دو دسته تقسيم می شوند:
– اکسیداسیون شیمیایی کلاسیک
– اکسیداسیون پیشرفته
در تصفیه های شیمیایی کلاسیک معمولا يك عامل اکسید کننده را به آب حاوی آلودگی اضافه ميكنند تا آلودگي ها توسط آن عامل اكسيد كننده اكسيد شده و آلاينده ها از پساب حذف شوند.
افزودنی ها كه سبب اكسيد شدن آلودگی ها در پساب می شوند شامل موارد زير می باشند:
كلر
پرمنگنات پتاسيم
پراكسيد هيدروژن
ازن
كه هريك از اين عوامل اكسيد كننده طي واكنش هاي مخصوص به خود سبب حذف آلودگي ها از پساب مورد نظر مي شوند.
اكسيداسيون با كلر
كلر ،يك عامل اكسيد كننده مي باشد كه يا به صورت عنصري و يا به صورت هيپوكلريت ميتواند با قدرت سبب اكسيد كردن عوامل آلودگي همچون سيانيد شوند.
اكسيداسيون با پرمنگنات پتاسيم
از این اکسید کننده جهت حذف برخی از ترکیبات آلی استفاده می شود.عمدتا در حذف آلدئید ها، مرکاپتان ها، فنل و اسیدهای غیر اشباع به کار برده می شود . در طی واکنش، حلقه آروماتیک شکسته شده و مولکول با وضیعت خطی ایجاد می گردد.ترکیبات آلیفاتیک بیشتر اکسید شده و آب و دی اکسید کربن بوجود می آید.پیشرفت واکنش سریع بوده و بستگی زیادی به pH محیط دارند. pH به دلیل هزینه زیاد مواد مورد نیاز و سمیت آن برای آبزیان در مقیاس بزرگ توسعه نیافته است.
اکسیداسیون با پراکسید هیدروژن
پراکسید هیدروژن یک ترکیب اکسید کننده بسیار قوی است که جهت اکسیداسیون ترکیباتی چون فنل ها، سیانیدها، ترکیبات گوگردی و یونهای فلزی به کار گرفته شده است. ترکیب تجاری آن در آب محلول، بی رنگ و با درصد خلوص۷۰-۳۰ درصد می باشد.این ترکیب در طی تجزیه، اکسیژن و گرمای زیادی ایجاد می کند.مقادیر كمي از بعضی فلزات می تواند نقش کاتالیزوررا در فرآیندهای اکسیداسیون با پراکسید هیدروژن ایفا كند.این اکسید کننده یک ماده به نسبت بی خطر بوده و در تصفیه بسیاری از مواد آلی و معدنی و حلقه بنزنی به كار گرفته شده است. دامنه pH بهینه دراين فرايند بين ۴-۳ متغییر است.پراکسید هیدروژن در حضور كاتاليزور ،رادیکال هیدروکسیل ايجاد ميكند که اين راديكال هيدروكسيل با مواد آلی ترکیب شده و ساختار آن ها را متلاشي ميكند. از مزاياي مهم اين اكسيد كننده ، قيمت مناسب ، سهولت حمل ونقل ، عدم ايجاد محصولات سمي و حلاليت بالا در آب مي باشد.
اکسیداسیون با ازن
ازن براي موارد مختلفي همچون حذف رنگ، گندزدايي، حذف بو و طعم، حذف منیزیم و ترکیبات آلی كاربرد دارد.ازن درشرایط دما و فشار استاندارد، حلاليت كمي دارد وهمچنين ناپايدار است. حلاليت ازن تقريبا 10 برابر حلاليت اكسيژن در آب است.قدرت اکسیدکنندگی ازن دو برابر قدرت اكسيد كنندگي پراکسید هیدروژن می باشد.ازن در تصفيه پساب هاي حاوي تركيبات فني به كار مي رود.و هدف آن در تصفیه پساب های محتوی ترکیبات فنلی، اکسیدکردن این ترکیبات به مواد آلی واسطه است.اگرچه سمی هستند ولی کاملا از نظر زیستی قابل تجزیه می باشند.
جدول زیر قدرت اکسیدکنندگی بعضی از عوامل اکسید کننده را نشان می دهد
عامل اکسیدکننده
پتانسیل اکسیداسیون(ولت)
فلوئور 3/03
رادیکال هیدروکسیل 2/80
اکسیژن اتمی 2/42
ازون 2/07
پراکسیدهیدروژن 1/77
پرمنگنات 1/67
اسید هیپوبرمو 1/59
دی اکسید کلر 1/50
اسیدهیپوکلرو 1/49
اسیدهیپویدو 1/45
گازکلر 1/36
ید 0/54
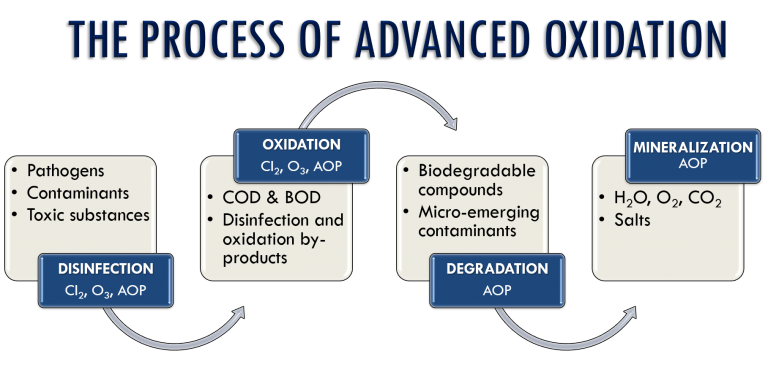
فرايند اكسيداسيون پيشرفته – َAOP

.فرايند اكسيداسيون پيشرفته يكي از روش هاي مؤثر در تصفيه پساب هاي حاوي آلاينده هاي سمي و صنعتي مي باشد. با توجه به اينكه فرايندهاي بيولوژيكي متداول در تصفيه پساب هاي صنعتي ، در حذف و ازبين بردن مقادير بالاي تركيبات آلي ، ناتوان هستند، از فرايندهاي اكسيداسيون شيميايي كه با توليد راديكال هاي هيدروكسيل در محل ، موجب اكسيداسيون و تجزيه آنها مي شود، استفاده مي كنند. در اين روش اكسيژن خالص و ازن را در فواصل مختلف به فاضلاب مي افزايند و اين فرايند ها در تصفيه پساب ها و نيز تصفيه نهايي آب شرب مورد استفاده قرار مي گيرند. اين كار سبب خاصيت اكسيدكنندگي قوي درفاضلاب شده و به حذف BOD فاضلاب منتهي مي شود. كه باعث حذف تمامي باكتري ها و ويروس ها در تصفيه نهايي آب مي شود.
راديكال های هيدروكسيل از طرق مختلف توليد می شوند كه عبارتند از:
تركيب تابش ماوراي بنفش و افزودن و افزودن آب اكسيژنه
افزودن توأم گاز ازن و آب اكسيژنه
تركيب تابش ماوراي بنفش و افزودن ازن
تركيب تابش ماوراي بنفش و TiO2
تركيب تابش ماوراي بنفش و ازن و پراكسيد هيدروژن
فتوفنتون
الكتروفنتون
واكنش فنتون
افزودن آب اكسيژنه و نمك آهن به عنوان كاتاليزور
ازن زني در PH قليايي
كاربرد فرايند اكسيداسيون پيشرفته
تصفيه شيرابه زباله
از بين بردن مواد راديو اكتيو
تصفيه پسابهاي نفتي و پترو شيمي
از بين بردن تركيبات شيميايي حاصل از سموم كشاورزي
تصفيه پسابهاي با بار آلي بسيار بالا
حذف بو از گاز خروجي از صنايع
تصفيه خاكهاي آلوده به تركيبات شيميايي
پيش تصفيه در شكست ماكرو مولكول هاي غير قابل تصفيه به روش بيولوژيكي
دلیل نامگذاري این فرایندها به نام فرایند اکسیداسیون پیشرفته، تولید رادیکال هیدروکسیل است که ضمن بالاتر بردن قدرت اکسیداسیون، از نظر شرایط عملیات و محصولات جانبی مضر براي محیط زیست تفاوت بسیار زیادي با روشهاي متعارف دارد.
اخیراً بیشترین توجه به جداسازي منابع آلی سخت تجزیه پذیر و تصفیه فاضلاب سمی به وسیله فرایندهاي اکسیداسیون پیشرفته (AOP) با استفاده از کاتالیزورهاي همگن یا ناهمگن معطوف شده است. تأثیر AOP به شرایط تصفیه از جمله pH ، دما و غلظت واکنشگرها بستگی دارد. همچنین فرایندهاي اکسیداسیون پیشرفته می تواند براي تخریب آلاینده هایی که بعد از فرایند تصفیه در پساب باقیمانده است، به کاربرده شود.

مزیتهای روش AOP
از مزیت های روش AOP می توان توجه به پسابهایی که به مواد مختلف آلوده هستند را نام برد. موفقیت روشهای AOPبه بیشینه کاهش مواد جامد معلق، کلوئیدها و روغنها و سایر عاملهای محدودکننده وابسته است. فرایندهای اکسیداسیون پیشرفته هم از لحاظ اقتصادی به صرفه و هم در کاهش آلودگیها موثر هستند و به عنوان یکی از بهترین روشها برای پاکسازی مواد آلی پساب مطرح هستند. در سال های اخیر فرایندهای اکسیداسیون پیشرفته که بر مبنای تولید رادیکالهای آزاد و فعال به ویژه هیدروکسیل متکی هستند به دلیل قدرت بالای اکسایش بسیار مورد توجه قرار گرفته اند.
انواع روش های اکسیداسیون پیشرفته
فرایند فنتون ( Fe (II) | H2O2)
روش فنتون یکی از روش های اکسیداسیون سنتی است. که در آن فرایند تولید رادیکال های هیدروکسی غیرانتخابی از طریق واکنش بین پروکسید هیدروژن و نمکهای آهن دوظرفیتی به عنوان کاتالیزور صورت می گیرد. انجام واکنش، بستگی به غلظت رادیکالهای هیدروکسیل تولید شده در واکنش دارد.

پراکسید هیدروژن (H2O2)، به علت وضعیت ناپایدار و اینکه به راحتی اکسیژن اضافی اتمی خود را از دست می دهد، به عنوان یک ماده اکسید کننده عالی شناخته شده است که برای اکسید کردن آمین ها، آلدئیدها و سیانید ها، بدون استفاده از کاتالیست، مورد استفاده قرار گرفته است. یونهای آهن (Fe+2 ) عمده ترین کاتالیست استفاده شده برای اکسید کردن آلاینده های سخت تجزیه به همراه پراکسید هیدروژن می باشد؛ که به این فرایند فنتون گفته می شود. فرایند فنتون یکی از قدیمی ترین و قویترین فرایندهای اکسیداسیون به کار گرفته شده می باشد. اختلاط پراکسید هیدروژن و سولفات آهن (FeSO4 ) یا نمک های دیگر آهن دو ظرفیتی، در pH پایین (۲ تا ۴)، سبب تجزیه کاتالیتیکی پراکسید هیدروژن، توسط یون های آهن (II)، به رادیکال های هیدروکسیل می گردد.
به علت فراوانی و غیر سمی بودن یون های آهن و کاربرد آسان و نداشتن اثر مضر پراکسید هیدروژن بر محیط زیست، فرایند فنتون مقرون بصرفه و سازگار با محیط زیست می باشد. فرایند فنتون برای اکسید کردن بسیاری از آلاینده های آلی از قبیل: رنگ، فاضلاب های پر بار و دارویی، آب های زیر زمینی، تری هالومتان ها، آمین های آروماتیک، آلفاتیک های کلرینه، شیرابه زباله ها، حشره کش ها و مواد آلی مقاوم به تجزیه مورد استفاده قرار گرفته است. زمان واکنش در این فرایند پایین بوده و می تواند برای بار الی تا ۵۰۰۰ میلی گرم در لیتر ( بر حسب COD ) مورد استفاده قرار بگیرد.
از معایب فریاند فنتون این می باشد که فقط در pH های پایین انجام می شود و حرارت تولید شده می تواند منجر به خروج ماده آلی فرار از سیستم گردد. راندمان اکسیداسیون بستگی به pH و نسبت غلظت آهن (II) به پراکسید هیدروژن دارد. بهترین pH حدود ۳ می باشد. در pH بالا پراکسید هیدروژن خودبخود تجزیه می گردد و آهن به صورت هیدروکسید (Fe (OH)3 ) رسوب می کند و پراکسید هیدروژن به آب و اکسیژن، بدون تشکیل رادیکال هیدروکسیل، تجزیه خواهد شد. این در حالی است که در pH کمتر از ۳، یون های هیدروژن سبب بدام انداختن رادیکال های هیدروکسیل می گردند. در این فرایند کاتالیست توسط پراکسید هیدروژن دوباره احياء می گردد. محدودیت دیگر این روش، علاوه بر بهره برداری در pH پایین، احياء بسیار کند کاتالیست است، بنابراین برای انجام واکنش افزودن مستمر کاتالیست ضروری می باشد.
البته مطلوبیت این روش به دلیل فراوانی و غیرسمی بودن آهن، کاربرد آسان پروکسید و ایمنی زیست محیطی آن می باشد. واکنش در شرایط اسیدی مطابق معادله زیر می باشد.
یونهای یونهای +Fe2 و Fe3+ رادیکال OH· و پراکسید هیدروژن با مشارکت مجدد در چند مرحله واکنش شیمیایی دیگر، رادیکال HO2· را تولید می کنند. حذف کلی کربن آلی نیاز به مقدار زیاد اکسید کننده و یا زمان ماند طولانی دارد. از این رو تصفیه بیولوژیکی ارزان قیمت متعاقب یک پیش تصفیه با روش فنتون حتی با اکسیداسیون جزئی آلاینده ها روش کارآمدی در تصفیه چنین ترکیبی شناخته شده است.
فرایند فتوفنتون ( Fe (II) | H2O2 | UV)
افزودن پرتوهای UV به فرایند فنتون سبب افزایش احیاء کاتالیست و نیز تولید رادیکال هیدروکسیل می گردد که در نهایت باعث افزایش راندمان اکسیداسیون می شود. در فرایند فتوفنتون رادیکال هیدروکسیل با سه روش تولید می گردد که شامل
الف) تجزیه نوری پراکسید هیدروژن
ب) افزایش احیاء آهن (III) توسط پراکسید هیدروژن
ج) احیاء نوری آهن فریک (FeOH 2+) به آهن(II) می باشد
راندمان اکسیداسیون علاوه بر موارد فنتون به شدت نور UV نیز بستگی دارد. فرایند فتوفنتون نیز مانند فرایند فنتون در pH پایین بیشترین کارایی را دارد و در pH بالاتر از ۴ به علت رسوب هیدروکسید آهن و کاهش انتقال پرتوهایUV، راندمان اکسیداسیون کاهش می یابد.
از مزایای روش فتوفنتون راندمان بالاتر نسبت به فرایند فنتون می باشد. هر چند تفاوت زیادی در راندمان حذف آلاینده در مقایسه با فرایند فنتون وجود ندارد ولی افزایش معدنی سازی با این فرایند بسیار چشمگیر و در بعضی موارد تا حدود دو برابر نیز بوده است. بطور کلی علاوه بر فاکتور محدود کنندهpH در فرایند فتوفنتون، همانند همه فرایندهای نوری از معایب فرایند فتوفنتون کاهش نفوذ پرتوهای UV با افزایش کدورت پساب و در نتیجه کاهش راندمان می باشد.

فرایندهای فتو کاتالیستی
واژه فتوکاتالیست در اصل به معنی شتاب بخشیدن به یک واکنش فتونی توسط کاتالیست است. به طور دقیق تر، کاتالیست در شرایط تهییج شده یا عادی خود از طریق میان کنش با مواد واکنشگر یا محصولات اولیه، واکنش فتونی را تسریع خواهد کرد. کاتالیست ها انواع مختلف دارند. بهترین راه برای تمیز کردن آبهای آلوده استفاده از کاتالیستی است که برای تعداد زیادی از آلاینده ها کاربرد داشته باشد. نیمه هادی هایی که به عنوان فتوکاتالیست مورد استفاده قرار می گیرند باید دارای خصوصیات ویژه ای از قبیل شکاف انرژی مناسب، پایداری قابل قبول در مقابل نور، غیر سمی بودن، ارزان بودن و غیره باشند. مواد مختلفی مانند WO3 ،TiO2 ،ZnO ،ZrO2 ،CdS ،MoS2 ، Fe2O3 و کامپوزیتهای آنها به عنوان فتوکاتالیست در تجزیه آلایندههای آلی و معدنی مورد بررسی قرار گرفته اند.
فرایند فتوکاتالیز شامل دو تکنیک همزمان با شیوه های عمل متفاوت است:
الف) فتوشیمی که در آن انرژی بوسیله تابش فراهم می شود؛
ب) کاتالیز کردن که بر روی سرعت واکنش تاثیر می گذارد.
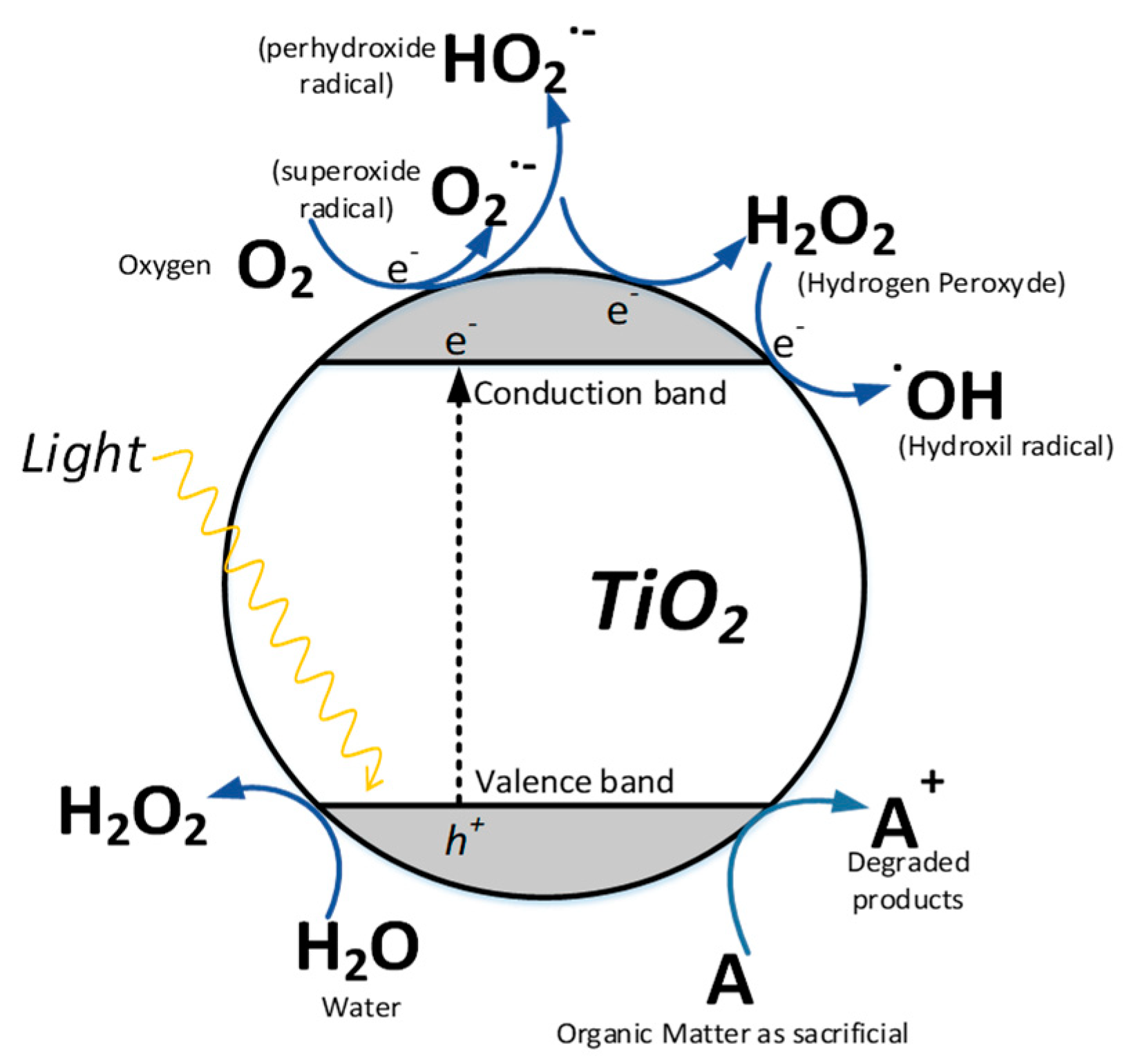
امروزه از نیمه هادیها بطور وسیعی جهت کاتالیزور در فرایندهای فتو کاتالیستی ناهمگن استفاده می شود. بر خلاف فلزات که حالت الکترونی پیوسته دارند، نیمه هادی ها دارای یک ناحیه خالی از انرژی هستند. به عبارت دیگر نیمه هادی ها از نظر انرژی دارای ساختار نواری هستند. سطوح انرژی که مربوط به پیوند کوالانسی میان اتم هاست، نوار ظرفیت و سطوح انرژی دیگر که در مکان بالاتری قرار گرفته اند نوار رسانش نامیده می شود.
منطقه تهییج که از بالای نوار ظرفیت پر شده و تا زیر نوار رسانش خالی گسترده شده است را شکاف نوری یا شکاف انرژی می نامند که تعیین کننده حساسیت نیمه رسانا به طول موج تابش است. جذب تابشی که انرژی بیشتر یا برابر با شکاف نواری (Ebg) نیمه رسانا داشته باشد، باعث ارتقاء الكترون از نوار والانسه به نوار رسانش شده و ایجاد حفره هایی در نوار والانس می نماید. در این حالت یک جفت الکترون شامل الکترون باند (ecb– ) الكترون حفره تولید می شود. آب توسط الکترون حفره به رادیکال حفره اکسید می گردد و اکسیژن توسط الکترون به رادیکال سوپراکساید احياء می گردد.
در بین فتوکاتالیزورها دی اکسید تیتانیم بهترین توافق را بین عملکرد کاتالیزوری و پایداری در محیط آبی را فراهم می کند و رایج ترین و مرسوم ترین ماده ای است که به عنوان فتوکاتالیزور استفاده شده است. عوامل متعددی مانند شدت نور و طول موج آن، اکسیژن محلول، pH و حضور یونها بر میزان تجزیه آلاینده ها در فتوراکتورها موثر است. تاثیر شدت و طول موج نور UV در اکسیداسیون یونهای هالیدی توسط اکسیژن در محلول TiO2 معلق نشان می دهد که تنها فتونهای با طول موج کمتر از لبه جذب TiO2 (تقريبا ۴۰۰ نانومتر) در واکنش موثرند.
انرژی خورشیدی متمرکز باعث تخریب بسیاری از مواد شیمیایی خطرناک از قبیل دی اکسینها، PCB ها، فورانها، بنزنها و متان های کلرینه شده می شود. تخریب این ترکیبات توسط فتونهای پر انرژی موجود در فرایندهای تخریب خورشیدی بر خلاف فرایندهای سوزاندن متداول، بطور محسوسی افزایش می یابد. همچنین افزایش شدت تابش، میزان تخریب ترکیبات آلی را افزایش می دهد.
دی اکسید تيتانيوم ، پراکسید هیدروژن و پرتوهای ماورای بنفش (TiO2 | H2O2 | UV)
راندمان فرایند فتوکاتالیتیکی با افزودن پراکسید هیدروژن افزایش می یابد. روش افزودن پراکسید هیدروژن مهم می باشد؛ به این علت که حضور پراکسید هیدروژن اضافی به عنوان بدام انداز رادیکال عمل می کنند. یکی از این روش ها تولید و افزودن پراکسید هیدروژن توسط فرایند فتوالکتروکاتالیتیکی در سطح الکترود کربن می باشد.
بنابراین توصیه می شود تولید الکتروشیمیایی پراکسید هیدروژن، با جریان مستمر و مقدار مناسب، سبب بهبود فرایند TiO2 / H2O2 /UV می گردد. از معایب روش دی اکسید تيتانيوم/ پراکسید هیدروژن/ پرتوهای ماورای بنفش، همانند سایر فرایندهای فتو کاتالیزوری، مصرف مداوم و بالای کاتالیست و هزینه بالای آن و همچنین عدم امکان جداسازی کاتالیست در صورت کاربری به صورت هموژن و یا ابعاد نانویی از پساب خروجی و وجود خود کاتالیست بعنوان آلاينده می باشد.
پراکسید هیدروژن وپرتوهای ماورای بنفش (H2O2 | UV)
در سیستم پراکسید هیدروژن/ پرتوهای ماورای بنفش با افزودن پرکسید هیدروژن به فرایند پرتودهی توسط اشعه ماورای بنفش، مقدار حذف آلاینده ها افزایش می یابد. پرکسید هیدروژن ارزانتر از تولید ازن می باشد و پیچیدگی های فرایند و ایمنی کاربرد آن از ازن سمی کمتر می باشد. فتولیز یک مول پر کسید هیدروژن منجر به تولید دو مول رادیکال هیدروکسیل خواهد شد.
این پدیده، از لحاظ تئوریکی، برای تصفیه فاضلاب عالی می باشد، ولی در عمل به علت پایین بودن ضریب از بین رفتن پراکسید هیدروژن جذب پرتو UV در طول موج ۲۵۴ نانومتر ضعیف می باشد؛ که این سبب کاهش راندمان تولید رادیکال هیدروکسیل می گردد. به علت پایین بودن این ضریب جذب، پراکسید هیدروژن اضافی و یا زمان پرتو دهی بیشتر با پرتوهای UV مورد نیاز می باشد. در تصفیه آب، غلظت بالای پراکسید هیدروژن در خروجی سیستم تصفیه مشکل ساز می باشد؛ به طوری که حد مجاز غلظت آن در آلمان۱/۰ میلی گرم در لیتر می باشد.
راندمان اکسیداسیون به مقدار رادیکال هیدروکسیل تولیدی از طریق تجزیه نوری پراکسید هیدروژن بستگی دارد. در صورتی که مقدار جذب UV توسط مواد موجود در آب یا فاضلاب افزایش یابد، پراکسید هیدروژن باید برای جذب UV رقابت نماید؛ که نتیجه آن سبب کاهش جذب UV و در نتیجه کاهش تولید رادیکال هیدروکسیل می گردد.
ازن جاذب شدیدتر UV نسبت به پراکسید هیدروژن می باشد، بنابراین تولید رادیکال هیدروکسیل در آن بیشتر است. ساده ترین روش تولید رادیکال های هیدروکسیل شکست فتوشیمیایی پراکسید هیدروژن توسط پرتوهای UV می باشد. به طور تئوریکی، با جذب هر کوانتوم پرتو UV دو رادیکال هیدروکسیل تشکیل می گردد با این حال این فرایند محدودیت های زیادی دارد. از اشکالات این سیستم، جذب مولی اندک UV توسط پراکسید هیدروژن نسبت به ازن در طول موج nm ۲۵۴ می باشد؛ که نتیجه آن نیاز به غلظت بالای پراکسید هیدروژن برای تولید رادیکال های هیدروکسیل می باشد.
پراکسید هیدروژن و ازن (H2O2 | O3)
نام دیگر فرایند پراکسید هیدروژن/ ازن، پروکسون می باشد. در فرایند پراکسید هیدروژن/ ازن، پراکسید هیدروژن سبب تجزیه ازن به رادیکال های هیدروکسیل می گردد. از مزیت روش پراکسید هیدروژن/ ازن، حذف آلاینده های مقاوم به تجزیه توسط ازن می باشد. نسبت غلظت ازن و پراکسید هیدروژن تاثیر زیادی بر راندمان فرایند اکسیداسیون دارد.
بهترین نسبت مولی ازن به پراکسید هیدروژن در فرایند پراکسید هیدروژن/ ازن در محدوده ۵/۰ تا ۱ می باشد که بستگی به حضور تسریع کننده های واکنش و بدام اندازهای رادیکال دارد. پراکسید هیدروژن هم می تواند به عنوان آغازگر واکنش و هم به عنوان بدام انداز رادیکال عمل کند. بنابراین یافتن نسبت مناسب ازن به پراکسید هیدروژن ضروری می باشد. پراکسید هیدروژن با از دست دادن پروتون به HO2– تبدیل شده و واکنش این باز با ازن سبب تجزیه ازن و تولید رادیکال هیدروکسیل می گردد.
پرتوهای ماورای بنفش و ازن (O3 | UV)
سیستم پرتوهای ماورای بنفش/ ازن اولین بار در سال ۱۹۷۵ به صورت تجاری در صنعت تصفيه آب به کار برده شد و سپس برای تصفیه آلاینده هایی مانند سیانیدها، حلال های کلرینه و حشره کش ها مورد استفاده قرار گرفت. در سیستم پرتوهای ماورای بنفش/ ازن اکسیداسیون آلاينده با فرایندهای اکسیداسیون مستقیم توسط ازن، تجزیه نوری و رادیکال های هیدروکسیل انجام می شود؛ که همه این فرایندها تحت تاثیر شرایط واکنش، کیفیت آب، مقدار پرتو UV جذب شده توسط آلاینده و واکنش پذیری آلاینده با پرتوهای UV می باشند.
سیستم پرتوهای ماورای بنفش ازن سبب حذف سریع تر ترکیبات هالوژنه آروماتیک، نسبت به ازن زنی تنها، می گردد. نسبت بهینه ازن به UV بستگی به آب و پارامترهای آن دارد. فتولیز ازن محلول در آب توسط پرتوهای UV سبب تولید پراکسید هیدروژن و در نتیجه تجزیه بیشتر ازن می شود که مکانیزم آن مشابه سیستم H2O2/ O3 می باشد.
ازن زنی کاتالیزوری
راندمان افرایند ازن زنی با تلفیق عواملی نظیر UV، پراکسید هیدروژن و کاتالیست های هموژنی نظیر Fe+2 ,Fe+3 ،Co ،Cu ،Ni ،RuO2 ،Co3O4 ،MnO2 ,Zn+2 ,Ag+ Ru بهبود می یاید که به آم ازن زنی کاتالیزوری یا COP10 می گویند.
به طور کلی این کاتالیست ها، به دلیل مصرف بالا و خروج آنها از سیستم به هنگام خروج پساب که خود می تواند به عنوان آلاینده ای در خروجی محسوب گردد، و همچنین پیچیدگی سنتز برخی از آنها بندرت به عنوان یک روش مناسب برای سیستم های تصفیه فاضلاب انتخاب می شوند. برای رفع این مشکل روش های گوناگونی از قبیل نشاندن کاتالیست بر روی سطح وجود دارد که سبب کاهش سطح تماس و اثر بخشی کاتالیست گردیده است.
اخیرا ترکیب ازن با کاتالیست هتروژن به منظور فعال نمودن تجزیه ازن و یا بهبود واکنش های ازن با ترکیبات آلی متعدد صورت گرفته است که شاملTiO2 ،CO3O4/CeO2،MgO ،Pt ،Au/AC ،Mn/TiO2 ،Ru/Al2O3 ،Pt/CNT ،ZnO ،CeO2 ،Fe3O4/CoO ،Mn/Co ،Mno ، FeC2O4،CeO ،Cd2O3 ، Fe2O3/CeO2 ،Fe2O3،CuFe2O4 ،Pd ،Cu/ZrO2 ، Ru/CeO2 و نانوتیوب کربن می باشند.
فرایند ازن زنی کاتالیزوری هتروژنیکی در واقع یک روش جدیدی از AOP می باشد که با افزودن کاتالیست سینتیک فرایند اکسیداسیون افزایش یافته، معدنی سازی و کاهش سمیت موثرتر و در نهایت هزینه ها کاهش می یابد. همچنین در فرایند ازن زنی کاتالیزوری دیگر مشکلات کاربرد پرتوهای UV، فشار و دمای بالا وجود نخواهد داشت.
اگر چه فلزات واسطه و اکسیدهای فلزی، کاتالیزورهای رایج در فرایند ازن زنی می باشند ولی اخیرا کربن فعال نیز به عنوان یک جایگزین جالب و مناسب برای تصفیه فاضلاب های حاوی رنگ و یا سایر آلاینده های آلی مانند اسیدهای کربوکسیلیک مورد توجه قرار گرفته است؛ زیرا ویژگی های شیمیایی سطح کربن فعال و گروه های سطحی اکسیژن دار نقش مهمی در مکانیسم واکنش دارند.
